Дитиоциан
| Дитиоциан | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Дитиоциан | ||
| Традиционные названия | Диродан, дитиоциан, тиоциан | ||
| Хим. формула | (SCN)2 | ||
| Физические свойства | |||
| Состояние | жидкое | ||
| Молярная масса | 116,168 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −2 °C | ||
| • разложения | ~10 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | растворяется | ||
| Классификация | |||
| Рег. номер CAS | 505-14-6 | ||
| PubChem | 68160 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30063 | ||
| ChemSpider | 61468 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
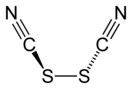
Дитиоциан (тиоциан, диродан, родан) — химическое соединение с формулой (SCN)2, структурная формла — N≡C–S–S–C≡N. Представляет собой белое твёрдое вещество (tпл = −2 °C), при комнатной температуре быстро полимеризующееся в красный паратиоциан (SCN)т. Легко растворяется в воде с частичным разложением, в присутствии растворённого кислорода разлагается заметно быстрее, растворяется в четырёххлористом углероде и сероуглероде[1]. Наряду с дицианом и оксоцианогеном (NC–O–O–CN) является псевдогалогенным соединением[2]-21.
Методы получения
[править | править код]Простейшие методы получения дитиоциана заключаются в мягком окислении тиоцианатов (роданидов) металлов иодом[3], бромом[4][5], водным раствором хлора[6], диоксидом марганца, солями меди(II) при пониженной температуре (около 0°С):
Последняя реакция сульфата меди(II) с роданидом калия с образованием дитиоциана и выпадающего в осадок роданида меди(I) аналогична реакциям окисления иодидов под действием солей меди(II) до свободного иода с образованием нерастворимых солей меди(I). Это химическое свойство, а также некоторая структрная аналогия молекул (NCS–SCN и I–I) позволяет отнести дитиоциан к псевдогалогенам.
Химические свойства
[править | править код]При комнатной температуре (более 20°С) быстро полимеризуется, превращаясь в паратиоциан[7]:
Медленный гидролиз тиоциана ведёт к образованию синильной, роданистоводородной и серной кислот[6]:
Сильные окислители превращают дитиоциан в углекислый газ, серную кислоту и аммонийную соль:
Реакции с щелочными металлами ведут к образованию соответствующих роданидов:
Аналогично поведению иода и иодидов, тиоциан образуют трис(тиоцианатный) комплекс в концентрированном растворе тиоцианата:
Дитиоциан окисляет иодиды до молекулярного иода:
Дитиоциан присоединяется по двойной свзяи алкенов с образованием α,β-дитиоцианатов[8]: 348.
Примечания
[править | править код]- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. — М., 2007. — С. 107. — 162 с. Архивировано 11 мая 2023 года.
- ↑ Marianna A. Busch. Halogen Chemistry☆ (англ.) // Reference Module in Chemistry, Molecular Sciences and Chemical Engineering. — Elsevier, 2018-01-01. — ISBN 978-0-12-409547-2. — doi:10.1016/b978-0-12-409547-2.11465-9. Архивировано 6 ноября 2022 года.
- ↑ Erik Söderbäck. Studien über das freie Rhodan (нем.) // Justus Liebig's Annalen der Chemie. — 1919. — Bd. 419, H. 3. — S. 217–322. — doi:10.1002/jlac.19194190302.
- ↑ William Howlett Gardner, Harold Weinberger, D. T. Englis, E. C. Price. Thiocyanogen Solution // Inorganic Syntheses / Harold Simmons Booth. — Hoboken, NJ, USA: John Wiley & Sons, Inc., 2007-01-05. — С. 84–86. — ISBN 978-0-470-13232-6, 978-0-470-13160-2. — doi:10.1002/9780470132326.ch29. Архивировано 12 мая 2023 года.
- ↑ Eric Block, Marc Birringer, Russell DeOrazio, Jürgen Fabian, Richard S. Glass, Chuangxing Guo, Chunhong He, Edward Lorance, Quangsheng Qian, T. Benjamin Schroeder, Zhixing Shan, Mohan Thiruvazhi, George S. Wilson, Xing Zhang. Synthesis, Properties, Oxidation, and Electrochemistry of 1,2-Dichalcogenins (англ.) // Journal of the American Chemical Society. — 2000-05-01. — Vol. 122, iss. 21. — P. 5052–5064. — ISSN 1520-5126 0002-7863, 1520-5126. — doi:10.1021/ja994134s. Архивировано 12 мая 2023 года.
- ↑ 1 2 Jon J. Barnett, Michael L. McKee, David M. Stanbury. Acidic Aqueous Decomposition of Thiocyanogen (англ.) // Inorganic Chemistry. — 2004-08-01. — Vol. 43, iss. 16. — P. 5021–5033. — ISSN 1520-510X 0020-1669, 1520-510X. — doi:10.1021/ic049356s. Архивировано 12 мая 2023 года.
- ↑ Palanichamy Krishnan, Suresh G. Advani, Ajay K. Prasad. Synthesis and evaluation of polythiocyanogen (SCN) as a rechargeable lithium-ion battery electrode material (англ.) // Journal of Power Sources. — 2011-09. — Vol. 196, iss. 18. — P. 7755–7759. — doi:10.1016/j.jpowsour.2011.04.048. Архивировано 20 июня 2018 года.
- ↑ Eric Block, Adrian L. Schwan. Electrophilic Addition of XY Reagents to Alkenes and Alkynes (англ.) // Comprehensive Organic Synthesis. — Elsevier, 1991. — P. 329–362. — ISBN 978-0-08-052349-1. — doi:10.1016/b978-0-08-052349-1.00097-4. Архивировано 25 мая 2022 года.








![{\displaystyle {\ce {(SCN)2 + KSCN <=> K[(SCN)3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb92c59e8a821f33356ca2e9ea8a48fa4a38527e)
