Нитрилотриметилфосфоновая кислота
| Нитрилотриметилфосфоновая кислота | |
|---|---|
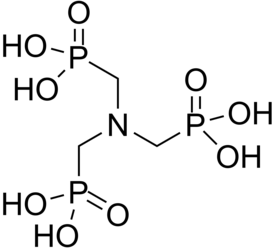  | |
| Общие | |
| Хим. формула | C3H12NO9P3 |
| Физические свойства | |
| Молярная масса | 299.07 г/моль |
| Плотность | 1.33 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | разлагается при 200 °C |
| Классификация | |
| Рег. номер CAS | 6419-19-8 |
| PubChem | 16698 |
| Рег. номер EINECS | 229-146-5 |
| SMILES | |
| InChI | |
| ChEBI | 168957 |
| ChemSpider | 15833 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Кислота нитрилотриметилфосфоновая
Синонимы: Аминотриметиленфосфоновая кислота, Аминотриметилфосфоновая кислота, Аминотри-(метанфосфоновая кислота), Нитрилотри-(метиленфосфоновая кислота), Нитрилотриметанфосфоновая кислота, НТФ
Нитрилометилтриенфосфоновая кислота — сильная шестиосновная кислота (pK1 0,3, рК2 1,5, рК3 4,64, рК4 5,88, рК5 7,3, рК6 12,1). С неорганическими и органическими основаниями образует соли. Окисляется пероксидами в N-оксид. В широком интервале рН образует устойчивые комплексы с катионами металлов. Значение рН (1% раствора при 20°С) не более 2.
Получение
[править | править код]НТФ получают взаимодействием соединений фосфора (фосфористой кислоты, треххлористого фосфора или монометилфосфита) с аммиаком и формальдегидом в водной среде.
[NH3]+3CH2O+3PCl3+6H2O=N(CH2PO3H2)3+9HCl
К раствору конц. соляной кислоты при энергичном перемешивании и температуре 40оС прибавляют одновременно по каплям смесь треххлористого фосфора, 37%-ного раствора формалина и аммиачной воды поддерживая заданную температуру скоростью прибавления реагентов и внешним охлаждением. По окончании прибавления реакционную массу нагревают до 100оС и выдерживают при этой температуре в течение 1 ч для более полного удаления выделяющегося хлористого водорода. Упаривают, охлаждают, осадок отфильтровывают.
Термическая стабильность
[править | править код]Термическая устойчивость водных растворов НТФ довольно высока и зависит от pH; так в кислых 1,0М растворах разложение НТФ начинается при 125оС. Основными продуктами распада в интервале температур от 125 до 190оС являются N-метилиминодиметиленфосфононовая CH3N(CH2PO3H2)2, иминодиметиленфосфоновая NH(CH2PO3H2)2, гидроксиметиленфосфоновая HOCH2PO3H2 и фосфористая кислоты. Термолиз растворов НТФ при температуре более 200оС приводит к появлению новых продуктов распада: аминометиленфосфоновой и N,N-диметилиминометиленфосфоновой кислот, а также аминов содержащих фрагменты CH3-N и фосфорной кислоты.[1]
Применение
[править | править код]В нефтедобывающей промышленности в качестве регулятора физико-химических свойств буровых и тампонажных растворов (замедление сроков схватывания цементного раствора), в качестве ингибитора солеотложения в процессах добычи нефти; в строительстве в качестве замедлителя сроков схватывания бетонных смесей в производстве монолитного и сборного железобетона; в теплоэнергетике в качестве ингибитора солеотложения в различных теплообменных аппаратах; в целлюлозно-бумажной промышленности в процессе отбелки целлюлозы всех видов на стадии хелатации. Использование НТФ кислоты и её солей в качестве активного начала в ингибиторах отложения сульфатных и карбонатных солей позволяет полностью предотвратить солеотложение в оборудовании скважин и в теплообменниках установок термохимического обезвоживания и обессоливания нефти. При бурении скважин НТФ кислота эффективно снижает вязкость естественных глинистых растворов, оставаясь стабильной в течение длительного времени.
Производство монолитного бетона в условиях сухого жаркого климата; возведение массивных монолитных конструкций; приготовление бетонных смесей, транспортируемых на большие расстояния.
Внешний вид
[править | править код]Бесцветный или слегка зеленоватый кристаллический сыпучий порошок. Технические характеристики: Массовая доля основного вещества в высушенном техническом продукте, %, не менее 98. Фосфористой кислоты (РО3), % не более 1.5
Сноски
[править | править код]- ↑ Комплексоны и комплексонаты металлов / Дятлова Н.М., Темкина В.Я., Попов К.И. М:Химия, 1988, 544 с. ISBN 5-7245-0107-4
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |