ETF-дегидрогеназа
| ETF-дегидрогеназа | |
|---|---|
 Ленточная диаграмма ETF-дегидрогеназы. Каждый функциональный домен покрашен своим цветом. Голубой полоской обозначена внутренняя мембрана митохондрии. | |
| Обозначения | |
| Символы | ETFD; ETF-QO |
| Entrez Gene | 2110 |
| HGNC | 3483 |
| OMIM | 231675 |
| PDB | 2GMH |
| RefSeq | NM_004453 |
| UniProt | Q16134 |
| Другие данные | |
| Шифр КФ | 1.5.5.1 |
| Локус | 4-я хр. , 4q 4q32.1 |
ETF-дегидрогеназа или (электронпереносящий флавопротеин)-дегидрогеназа[1] (сокр. от англ. electron transfer flavoprotein-ubiquinone dehydrogenase) — фермент, который переносит электроны с электронпереносящего флавопротеина (ETF), растворённого в матриксе митохондрий, на мембранный переносчик электронов — убихинон[2][3]. Этот фермент есть как у прокариот, так и эукариот. У этого энзима есть две простетические группы: флавин и железосерный кластер[4]. Нехватка ETF-дегидрогеназы у человека вызывает наследственное заболевание глутаровая ацидемия второго типа[5]. Кроме того, этот фермент — третья точка поступления электронов в ЭТЦ.
Функция[править | править код]
У млекопитающих этот фермент важен в β-окислении жирных кислот, катаболизме аминокислот и холина[6][7]. Он связывает β-окислении жирных кислот и прочие процессы с окислительным фосфорилирование. Множество ацетил-СоА-дегидрогеназ осуществляют окисление разных субстратов (например жирных кислот), перенося электроны на электронперносящий флавопротеин (ETF). ETF-дегидрогеназа в свою очередь окисляет этот белок и переносит электроны на растворённый во внутренней мембране митохондрий убихинон, восстанавливая его до убихинола, который затем поступает в дыхательную цепь переноса электронов.
Ацил-КоА → Ацил-КоА-дегидрогеназа → ETF → ETF-дегидрогеназа → Q → Комплекс III
У растений ETF-Q-дегидрогеназа важна для выживания во время стресса и длительного периода темноты[8].
Реакция[править | править код]
ETF-дегидрогеназа катализирует следующую реакцию[9]:
- ETFвосстановленный + Q → ETFокисленный + QH2.
Механизм[править | править код]
Точный механизм восстановления убихинона неизвестен, но существуют две гипотезы. Согласно первой гипотезе электроны по одному передаются с ETF на низкопотенциальный ФАД. В результате в восстановленном состоянии один электрон остаётся на ФАД, а другой на железном центре. После этого восстанавливается убихинон, с переходом через стадию семихинона. Согласно второй гипотезе ETF передаёт электроны на железосерный центр, после чего происходит быстрый переброс между двумя центром и ФАД. После наступления равновесия, всё остальное происходит по вышеописанной схеме.
Структура фермента[править | править код]
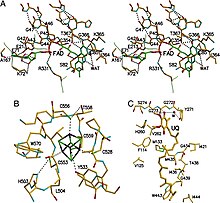
ETF-дегидрогеназа состоит из одного структурного домена и трёх близкорасположенных функциональных доменов: ФАД-связыввающий домен, 4Fe4S-связывающий домен и убихинон-связывающий домен[10]. ФАД глубоко погружён в белковую часть своего домена. Множество водородных связей и положительный конец диполя из α-спирали оказывают влияние на редокс-потенциал ФАД и, возможно, стабилизируют семихинон-радикал. Железосерный кластер 4Fe-4S также стабилизирован обширными водородными связями вокруг самого кластера и его цистеинов. Связывание убихинона происходит в глубоком гидрофобном кармане, который у этого фермента отличается от других убихинон-связывающих белков, таких как сукцинатдегидрогеназа. В отличие от других убихинон-связывающих ферментов, этот фермент прикрепляется к поверхности мембраны и не пересекает липидный бислой[11].
В медицине[править | править код]
Недостаток ETF-дегидрогеназы приводит к развитию глутаровой ацидимии второго типа (также известной как множественная ацил-КоА-дегидрогеназная недостаточность), которая характеризуется нарушением распада жирных кислот и аминокислот[12]. Болезнь может вызывать ацидоз или гипогликимию. К другим симптомам относится общая слабость, увеличенная печень, сердечная недостаточность и пониженное содержание левокарнитина. В более тяжёлых случаях могут наблюдаться врожденные пороки и полный метаболитический кризис[13][14][15]. С точки зрения генетики — это аутосомное рецессивное наследственное заболевание. По этой причине оно встречается довольно редко. У большинства пациентов выявлена однонуклеотидная замена в месте взаимодействия ФАД и убихинона[16][17] Более лёгкие формы этого расстройства поддаются лечению рибофлавиновой терапией, однако, из-за разнообразия мутаций, приводящих к развитию заболевания, симптоматика и соответствующее лечение могут сильно разниться[18][19].
См. также[править | править код]
Примечания[править | править код]
- ↑ Класс 1: Оксидоредуктазы (катализируют окислительно-восстановительные реакции). Дата обращения: 30 декабря 2015. Архивировано 9 февраля 2016 года.
- ↑ Ghisla S., Thorpe C. Acyl-CoA dehydrogenases. A mechanistic overview (англ.) // European Journal of Biochemistry / FEBS[англ.] : journal. — 2004. — February (vol. 271, no. 3). — P. 494—508. — doi:10.1046/j.1432-1033.2003.03946.x. — PMID 14728676.
- ↑ He M., Rutledge S.L., Kelly D.R., Palmer C.A., Murdoch G., Majumder N., Nicholls R.D., Pei Z., Watkins P.A., Vockley J. A new genetic disorder in mitochondrial fatty acid beta-oxidation: ACAD9 deficiency (англ.) // American Journal of Human Genetics[англ.] : journal. — 2007. — July (vol. 81, no. 1). — P. 87—103. — doi:10.1086/519219. — PMID 17564966. — PMC 1950923.
- ↑ Watmough N.J., Frerman F.E. The electron transfer flavoprotein: ubiquinone oxidoreductases (англ.) // Biochimica Et Biophysica Acta[англ.] : journal. — 2010. — December (vol. 1797, no. 12). — P. 1910—1916. — doi:10.1016/j.bbabio.2010.10.007. — PMID 20937244.
- ↑ Vianey-Liaud C., Divry P., Gregersen N., Mathieu M. The inborn errors of mitochondrial fatty acid oxidation (англ.) // Journal of Inherited Metabolic Disease[англ.] : journal. — 1987. — Vol. 10 Suppl 1. — P. 159—200. — doi:10.1007/bf01812855. — PMID 3119938.
- ↑ Ikeda Y., Dabrowski C., Tanaka K. Separation and properties of five distinct acyl-CoA dehydrogenases from rat liver mitochondria. Identification of a new 2-methyl branched chain acyl-CoA dehydrogenase. (англ.) // The Journal of biological chemistry. — 1983. — Vol. 258, no. 2. — P. 1066—1076. — PMID 6401712.
- ↑ Ruzicka F. J., Beinert H. A new iron-sulfur flavoprotein of the respiratory chain. A component of the fatty acid beta oxidation pathway. (англ.) // The Journal of biological chemistry. — 1977. — Vol. 252, no. 23. — P. 8440—8445. — PMID 925004.
- ↑ Ishizaki K., Larson T. R., Schauer N., Fernie A. R., Graham I. A., Leaver C. J. The critical role of Arabidopsis electron-transfer flavoprotein:ubiquinone oxidoreductase during dark-induced starvation. (англ.) // The Plant cell. — 2005. — Vol. 17, no. 9. — P. 2587—2600. — doi:10.1105/tpc.105.035162. — PMID 16055629.
- ↑ Ramsay R.R., Steenkamp D.J., Husain M. Reactions of electron-transfer flavoprotein and electron-transfer flavoprotein: ubiquinone oxidoreductase (англ.) // The Biochemical Journal[англ.] : journal. — 1987. — February (vol. 241, no. 3). — P. 883—892. — PMID 3593226. — PMC 1147643.
- ↑ Zhang J., Frerman F.E., Kim J.J. Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — October (vol. 103, no. 44). — P. 16212—16217. — doi:10.1073/pnas.0604567103. — PMID 17050691. — PMC 1637562.
- ↑ Zhang J., Frerman F. E., Kim J. J. Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2006. — Vol. 103, no. 44. — P. 16212—16217. — doi:10.1073/pnas.0604567103. — PMID 17050691.
- ↑ Frerman F. E. Goodman S. I. Deficiency of Electron Transfer Flavoprotein or Electron Transfer Flavoprotein:Ubiquinone Oxidoreductase in Glutaric Acidemia Type II Fibroblasts (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1985. — Vol. 82, no. 13. — P. 4517—4520. — doi:10.1073/pnas.82.13.4517.
- ↑ Galloway J.H., Cartwright I.J., Bennett M.J. Abnormal myocardial lipid composition in an infant with type II glutaric aciduria (англ.) // Journal of Lipid Research[англ.] : journal. — 1987. — March (vol. 28, no. 3). — P. 279—284. — PMID 3572253.
- ↑ Singla M., Guzman G., Griffin A.J., Bharati S. Cardiomyopathy in multiple Acyl-CoA dehydrogenase deficiency: a clinico-pathological correlation and review of literature (англ.) // Pediatric Cardiology : journal. — 2008. — March (vol. 29, no. 2). — P. 446—451. — doi:10.1007/s00246-007-9119-6. — PMID 17912479.
- ↑ Turnbull D.M., Bartlett K., Eyre J.A., Gardner-Medwin D., Johnson M.A., Fisher J., Watmough N.J. Lipid storage myopathy due to glutaric aciduria type II: treatment of a potentially fatal myopathy (англ.) // Developmental Medicine and Child Neurology[англ.] : journal. — 1988. — October (vol. 30, no. 5). — P. 667—672. — doi:10.1111/j.1469-8749.1988.tb04806.x. — PMID 3229565.
- ↑ Liang W.C., Ohkuma A., Hayashi Y.K., López L.C., Hirano M., Nonaka I., Noguchi S., Chen L.H., Jong Y.J., Nishino I. ETFDH mutations, CoQ10 levels, and respiratory chain activities in patients with riboflavin-responsive multiple acyl-CoA dehydrogenase deficiency (англ.) // Neuromuscular Disorders[англ.] : journal. — 2009. — March (vol. 19, no. 3). — P. 212—216. — doi:10.1016/j.nmd.2009.01.008. — PMID 19249206.
- ↑ Goodman S.I., Binard R.J., Woontner M.R., Frerman F.E. Glutaric acidemia type II: gene structure and mutations of the electron transfer flavoprotein:ubiquinone oxidoreductase (ETF:QO) gene (англ.) // Molecular Genetics and Metabolism[англ.] : journal. — 2002. — Vol. 77, no. 1—2. — P. 86—90. — doi:10.1016/S1096-7192(02)00138-5. — PMID 12359134.
- ↑ Olsen R.K., Olpin S.E., Andresen B.S., Miedzybrodzka Z.H., Pourfarzam M., Merinero B., Frerman F.E., Beresford M.W., Dean J.C., Cornelius N., Andersen O., Oldfors A., Holme E., Gregersen N., Turnbull D.M., Morris A.A. ETFDH mutations as a major cause of riboflavin-responsive multiple acyl-CoA dehydrogenation deficiency (англ.) // Brain[англ.] : journal. — Oxford University Press, 2007. — August (vol. 130, no. Pt 8). — P. 2045—2054. — doi:10.1093/brain/awm135. — PMID 17584774.
- ↑ Rhead W., Roettger V., Marshall T., Amendt B. Multiple acyl-coenzyme A dehydrogenation disorder responsive to riboflavin: substrate oxidation, flavin metabolism, and flavoenzyme activities in fibroblasts (англ.) // Pediatric Research[англ.] : journal. — 1993. — February (vol. 33, no. 2). — P. 129—135. — doi:10.1203/00006450-199302000-00008. — PMID 8433888.
Внешние ссылки[править | править код]
- ENZYME entry on EC 1.5.5.1 Архивная копия от 16 мая 2011 на Wayback Machine
- BRENDA entry on EC 1.5.5.1
- OMIM 231680