Бензидин
| Бензидин | |
|---|---|
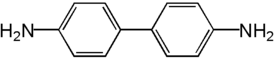  | |
| Общие | |
| Хим. формула | C12H12N2 |
| Физические свойства | |
| Молярная масса | 184,24 г/моль |
| Плотность | 1,25 ± 0,01 г/см³[1] |
| Термические свойства | |
| Температура | |
| • плавления | 122-125 °C |
| • кипения | 752 ± 1 ℉[1] |
| Классификация | |
| Рег. номер CAS | 92-87-5 |
| PubChem | 7111 |
| Рег. номер EINECS | 202-199-1 |
| SMILES | |
| InChI | |
| RTECS | DC9625000 |
| ChEBI | 80495 |
| Номер ООН | 1885 |
| ChemSpider | 6844 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Бензидин (4,4'-диаминодифенил) — белые или слегка желтоватые мелкоигольчатые кристаллы, темнеющие на свету и воздухе. Трудно растворим в воде, легко — в спирте и эфире. Впервые получен в 1845 г. Н. Н. Зининым.
Синтез[править | править код]
В промышленности бензидин синтезируют из нитробензола. На первой стадии нитробензол восстанавливают цинком в щелочной среде до 1,2-дифенилгидразина (гидразобензола). Затем гидразобензол под действием сильных кислот подвергается перегруппировке в бензидин (бензидиновая перегруппировка):
Реакция идёт по [5,5]-сигматропному механизму, перегруппировке подвергается N,N'-дипротонированный 2,2-дифенилгидразин:
Свойства[править | править код]
По своим химическим свойствам бензидин является типичным ароматическим амином. С минеральными кислотами он образует соли, из которых наибольшее значение имеют гидрохлориды и гидросульфаты. Моно- и дигидросульфат бензидина, а также моногидрохлорид плохо растворимы в воде, дигидрохлорид бензидина — хорошо растворим.
Для бензидина типичны реакции электрофильного замещения в ароматическом ядре. Так, при действии хлора или брома на суспензию гидрохлорида бензидина в концентрированной соляной кислоте образуются соответствующие 3,5,3',5'-тетрагалогенпроизводные. Сульфат бензидина в концентрированной серной кислоте нитруется нитратом калия до 2-нитро- и 2,2'-динитробензидинов; при нагревании сульфата бензидина в концентрированной серной кислоте до 170°С происходит моносульфирование с образованием бензидин-3-сульфокислоты, а до 210°С — дисульфирование до бензидин-3,3'-дисульфокислоты.
Бензидин алкилируется по аминогруппам как под действием алкилгалогенидов, так и спиртами при катализе никелем Ренея с образованием N,N'-диалкилбензидинов[2]. Под действием азотистой кислоты в соляной кислоте бензидин диазотируется с образованием бис-диазониевой соли, диазогруппы которой могут быть замещены на галогены по Зандмейеру или по Шиману[3] или введены в реакцию азосочетания.
Применение[править | править код]
До 70-х годов XX века бензидин широко применялся в производстве азокрасителей азосочетанием его бис-диазониевой соли с фениламино- и нафтиламиносульфокислотами (бензидиновые красители) однако с 1970-х годов после обнаружения его канцерогенности в ряде стран его промышленное производство и использование было запрещено. В настоящее время бензидиновые красители используются в качестве индикаторов или при окраске биологических препаратов, как, например, конго красный, получаемый азосочетанием 1-аминонафталин-4-сульфокислоты с бис-диазониевой солью бензидина:

В аналитической химии используется в качественном и количественном анализе для определения ряда окислителей, как катионов (Cu2+ , Au3+, Hg2+ и пр.), так и анионов (S2O82−, [Fe(CN)6]3− и др.), которые окисляют бензидин в кислой среде до окрашенных в жёлтый, а в нейтральной — в синий цвет соединений хиноидной структуры.
Бензидин также используется в медицинской диагностике (бензидиновая проба, синоним — реакция Грегерсена) для обнаружения крови. Проба основана на окислении бензидина перекисью водорода за счет каталитической пероксидазной активности крови с появлением зеленой или синей окраски.
Токсичность[править | править код]
Бензидин, подобно многим ароматическим аминам, токсичен. Эпидемиологические исследования рабочих, контактировавших с бензидином при производстве красителей, выявили повышенную заболеваемость раком, преимущественно рак мочевого пузыря[4].
Литература[править | править код]
- Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — 623 с. — 100 000 экз.
Примечания[править | править код]
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0051.html
- ↑ Rip G. Rice and Earl J. Kohn. N,N'-Diethylbenzidine. Organic Syntheses, Coll. Vol. 4, p.283 (1963); Vol. 36, p.21 (1956). Дата обращения: 15 января 2013. Архивировано из оригинала 14 января 2011 года.
- ↑ G. Schiemann and W. Winkelmüller. 4,4'-Difluorobiphenyl. Organic Syntheses, Coll. Vol. 2, p.188 (1943); Vol. 18, p.20 (1938). Дата обращения: 15 января 2013. Архивировано из оригинала 19 октября 2012 года.
- ↑ ATSDR - Toxicological Profile: Benzidine. Дата обращения: 15 января 2013. Архивировано 20 января 2013 года.

