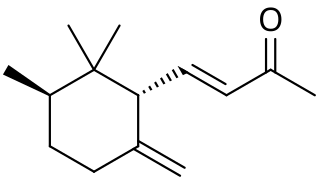
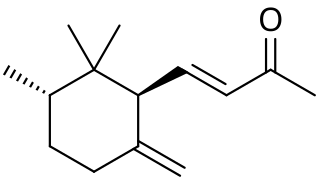
Ирон (вещество)
Ирон
| ||||
|---|---|---|---|---|
| Изомеры | ||||
| ||||
Общие
| ||||
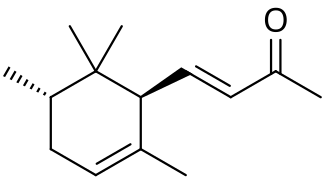
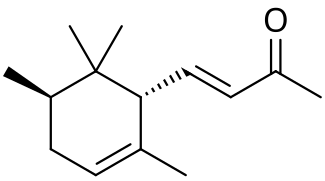
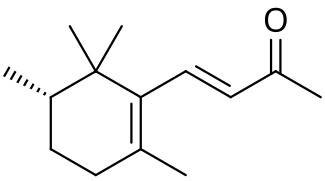
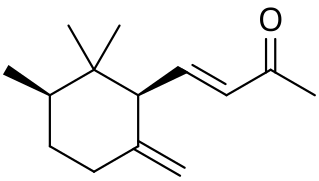
| Систематическое наименование | α: (E)-4- (2,5,6,6-tetramethylcyclohex-2-en-1-yl)but-3-en-2-one β: (E)-4- (2,5,6,6-tetramethylcyclohexen-1-yl)but-3-en-2-one γ: (E)-4-[ (1S,3R)-2,2,3-trimethyl-6-methylidenecyclohexyl]but-3-en-2-one
| |||
| Хим. формула | C14H22O | |||
Физические свойства
| ||||
| Молярная масса | 206,3239 г/моль | |||
| Плотность | α: 0,914 г/см³ β: 0,922 г/см³ γ: 0,9 г/см³
| |||
Термические свойства
| ||||
| Т. кип. | α: 278,7 ℃ β: 294,4 ℃ γ: 279,3 ℃
| |||
| Т. всп. | α: 118,4 ℃ β: 127,1 ℃ γ: 118,7 ℃
| |||
Классификация
| ||||
| Номер CAS | α: 79-69-6 β: 79-70-9 γ: 79-68-5
| |||
| PubChem | α: 5371002 β: 5375215 γ: 6433146
| |||
| ChEBI | α: 10284 β: — γ: —
| |||
α: CC1CC=C (C(C1(C)C)C=CC(=O)C)C β: CC1CCC (=C(C1(C)C)C=CC(=O)C)C γ: CC1CCC (=C)C(C1(C)C)C=CC(=O)C
| ||||
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | ||||
Ироны — группа метилиононовых душистых веществ, используемых в парфюмерии и получаемых из ирисового масла[1], в частности, ирисового корня.
Получение
[править | править код]Ирисовое масло получается путём паровой дистилляции корневищ ириса бледного, содержащих (–)-транс-α-ирон, (+)-цис-γ-ирон, (+)-цис-α-ирон, (+)-β-ирон и (+)-транс-γ-ирон. Корневища ириса германского содержат энантиомеры тех же иронов[2]. Ирон был впервые выделен из ирисового масла Иоганном Тиманом и Фридрихом Крюгером; они также определили, что он представляет собой метилкетон (на основании реакций разложения и сравнения с α- и β-иононами) и дали ему название[3].
Попытки искусственно синтезировать ироны предпринимались с 1940-х годов. Большинство ранних способов синтеза заключались в электрофильной циклизации 9-метил-псевдоионона или других интермедиатов[2]. Наименьшее количество побочных продуктов получалось при использовании трифторида бора в качестве циклизующего агента[4].
Ирон, полученный путём конденсации 6-метилцитраля с ацетоном с последующей циклизацией образующегося псевдоирона, представляет собой смесь α- и β-изомеров[5].
Изомеры
[править | править код]Ирон имеет 10 изомеров; в частности, α- и γ-ироны имеют по четыре стереоизомерных модификации, обусловленных цис-транс-изомерией[6].
-
(+)-цис-α-ирон
-
(–)-цис-α-ирон
-
(+)-транс-α-ирон
-
(–)-транс-α-ирон
-
(+)-β-ирон
-
(–)-β-ирон
-
(+)-цис-γ-ирон
-
(–)-цис-γ-ирон
-
(+)-транс-γ-ирон
-
(–)-транс-γ-ирон
Примечания
[править | править код]- ↑ Council of Europe, August 2007 Natural Sources of Flavourings, Volume 2 в «Книгах Google»
- ↑ 1 2 Swift, K. A. Current Topics in Flavours and Fragrances: Towards a New Millennium of Discovery. — Springer Science & Business Media, 2012. — P. 19. — ISBN 9789401140225. Источник. Дата обращения: 12 апреля 2022. Архивировано 12 апреля 2022 года.
- ↑ Current Organic Chemistry. — Bentham Science Publishers, July 1997. — P. 154. Источник. Дата обращения: 13 апреля 2022. Архивировано 13 апреля 2022 года.
- ↑ Успехи химии, Том 26, Выпуски 1—6. — Учпедгиз Наркомпроса РСФСР, 1957. — P. 99. Источник. Дата обращения: 13 апреля 2022. Архивировано 13 апреля 2022 года.
- ↑ Зефиров, Н. С. Химическая энциклопедия, Том 1. — Советская энциклопедия, 1990. — P. 263. — ISBN 9785852700087. Источник. Дата обращения: 13 апреля 2022. Архивировано 13 апреля 2022 года.
- ↑ Горяев, М. И. Методы исследования эфирных масел / М. И. Горяев, И. Плива. — Издательство Академии наук Казахской ССР, 1962. — P. 488. Источник. Дата обращения: 13 апреля 2022. Архивировано 13 апреля 2022 года.