Вольфрамовая кислота
| Вольфрамовая кислота | |
|---|---|
 | |
  | |
| Общие | |
| Традиционные названия | Ортовольфрамовая кислота |
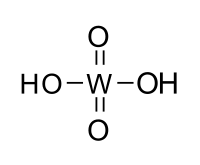
| Хим. формула | H2WO4 |
| Рац. формула | H2O4W |
| Физические свойства | |
| Состояние | Желтое кристаллическое или аморфное вещество |
| Молярная масса | 249,85 г/моль |
| Плотность | 5,59 г/см³ |
| Термические свойства | |
| Температура | |
| • кипения | 1473 °C |
| • разложения | 180 °C |
| Мол. теплоёмк. | 119,9 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1132 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | Малорастворима |
| • в | кислотах малорастворима, за исключением HF и аммония |
| Классификация | |
| Рег. номер CAS | 7783-03-1 |
| PubChem | 1152 |
| Рег. номер EINECS | 231-975-2 |
| SMILES | |
| InChI | |
| RTECS | YO7840000 |
| ChEBI | 36272 |
| ChemSpider | 1120 |
| Безопасность | |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Вольфра́мовая кислота́ (химическая формула — H2WO4) — моногидрат триоксида вольфрама — WO3 · H2O, или H2WO4 · H2O.
Известен также полугидрат состава 2WO3 · H2O[1].
История[править | править код]
Впервые была выделена в 1781 году из минерала шеелита шведским химиком-фармацевтом Карлом Вильгельм Шееле.
Химические свойства[править | править код]
Реагирует с щелочами, фтороводородом, раствором аммиака.
При подкислении щелочных растворов вольфраматов и при растворении их пиросульфатного сплава в воде на холоде выпадает белая гидратированная вольфрамовая кислота H2WO4 · H2O, которая при нагревании до 70—100 °C переходит в жёлтую H2WO4. Вторую молекулу воды вольфрамовая кислота теряет при температуре выше 180 °C, при этом переходя в оксид вольфрама(VI):
- .
Получение[править | править код]
Образуется при действии сильных кислот на растворы вольфраматов щелочных металлов. Вольфрам в смеси азотной и плавиковой кислот растворяется, образуя вольфрамовую кислоту. Триоксид вольфрама не растворяется в воде. Получить вольфрамовую кислоту можно следующим образом:
- .
Образуется при действии угольной кислоты на раствор вольфрамата натрия, то есть при пропускании углекислого газа через раствор соли вольфрамовой кислоты:
- .
Применение[править | править код]
- Адсорбент;
- Катализатор при гидрогенизации;
- Вещество для протравливания;
- Краситель в текстильной промышленности при крашении тканей;
- Промежуточный продукт в производстве металлического вольфрама.
Стандартизация[править | править код]
На вольфрамовую кислоту распространяется технические условия по ГОСТ 2197-78[2].
Примечания[править | править код]
- ↑ Günter, John R.; Amberg, Marcel; Schmalle, Helmut (1989). "Direct synthesis and single crystal structure determination of cubic pyrochlore-type tungsten trioxide hemihydrate, WO3 · 0.5H2O". Materials Research Bulletin. 24 (3): 289—292. doi:10.1016/0025-5408(89)90214-6.
- ↑ Кислота вольфрамовая. Технические условия. Архивировано 28 июля 2020 года.



