Орбитальное квантовое число
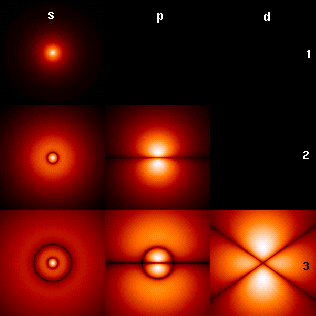
1, 2 и 3 справа — главные квантовые числа.
Орбитальное (побочное или азимутальное) квантовое число — в квантовой физике квантовое число ℓ, определяющее форму распределения амплитуды волновой функции электрона в атоме, то есть форму электронного облака. Характеризует число плоских узловых поверхностей. Определяет подуровень энергетического уровня, задаваемого главным (радиальным) квантовым числом n и может принимать значения
Каждому значению соответствует орбиталь особой формы. При атомная орбиталь независимо от значения главного квантового числа имеет сферическую форму (s-орбиталь). Значению соответствует атомная орбиталь, имеющая форму гантели (p-орбиталь). Ещё более сложную форму имеют орбитали, отвечающие высоким значениям , равным 2, 3 и 4 (d-, f-, g-орбитали)[1].
Является собственным значением оператора орбитального момента электрона, отличается от момента количества движения электрона j на оператор спина s:
Разность орбитального квантового числа и квантового числа полного момента не превосходит по абсолютной величине (спин электрона).
Примечания[править | править код]
- ↑ Третьяков Ю. Д., Дайнеко В. И., Казимирчик И. В. и др. Химия. Справочные материалы. — М.: Просвещение, 1984. — С. 17.
Ссылки[править | править код]
- R.B. Lindsay (1927). "Note on «pendulum» orbits in atomic models". Proc. Natl. Acad. Sci. 13: 413—419. Bibcode:1927PNAS...13..413L. doi:10.1073/pnas.13.6.413. PMC 1085028. PMID 16587189.
Для улучшения этой статьи по физике желательно:
|





