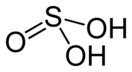
Сернистая кислота
| Сернистая кислота | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Сернистая кислота | ||
| Хим. формула | H2SO3 | ||
| Физические свойства | |||
| Состояние | Жидкость | ||
| Молярная масса | 82.07 г/моль | ||
| Плотность | 1,03 г/см³ | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 1,81 | ||
| Растворимость | |||
| • в воде | 14.73 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 7782-99-2 | ||
| PubChem | 1100 | ||
| Рег. номер EINECS | 231-973-1 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 48854 | ||
| ChemSpider | 1069 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Се́рнистая кислота́ (химическая формула — H2SO3) — химическая неорганическая кислота средней силы, существующая только в водном растворе. Образуется при растворении диоксида серы в воде.
Её соли и эфиры называются сульфи́тами и ги́дросульфи́тами.
Физические свойства
[править | править код]Сернистая кислота — это двухосновная кислота средней силы. Образуется при растворении диоксида серы в воде. Ввиду неустойчивости не может быть выделена в чистом виде из водных растворов.
Химические свойства
[править | править код]Кислота средней силы:
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
- Баланс реакции лежит далеко слева.
Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфиты (в избытке щёлочи):
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Необратимо окисляется кислородом до серной кислоты при +70 °C под давлением и в присутствии сульфата меди (II). Образующийся сульфит меди (II) окисляется кислородом до сульфата меди (II):
Физиологические свойства
[править | править код]Пары сернистой кислоты имеют примерно те же свойства воздействия на организм человека, что и её ангидрид, сернистый газ, — с той только разницей, что концентрация таких паров в случае кислоты будет всегда ниже. Тем не менее, сернистая кислота всегда приводит к стойкому раздражению дыхательных путей, не позволяющему человеку продолжительного пребывания в атмосфере, сколько-нибудь богатой такими парами. При постоянном действии на человека даже разрежённых испарений сернистой кислоты, сразу не производящей заметного раздражения дыхательных органов, всё равно проявляются катаральные воспаления соединительной оболочки глаз, возникают трудности дыхания, расстройство пищеварения, что, в конце концов, приводит к общему упадку сил организма.[1]
Применение
[править | править код]- Восстановитель, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей;
- Консервирование плодов, овощей, винных изделий;
- Осветление фруктовых соков, долгое время производимое при посредстве сернистого газа, на самом деле в своём механизме использует химическое воздействие сернистой кислоты;[2]
Примечания
[править | править код]- ↑ Ф. Ф. Эрисман. «Профессиональная гигиена». Избранные произведения: в 2 т. — М.: Медгиз, 1959 г.
- ↑ И. Н. Вольпер. Сахар: сладкий, горький, соленый — М.: «Химия и жизнь», № 10, 1965 г.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.