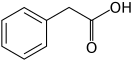
Фенилуксусная кислота
| Фенилуксусная кислота | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Фенилэтановая кислота | ||
| Традиционные названия | Фенилуксусная кислота | ||
| Хим. формула | C8H8O2 | ||
| Рац. формула | С6H5СH2COOH | ||
| Физические свойства | |||
| Молярная масса | 136,15 г/моль | ||
| Плотность | 1,228 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 77—78,5 °C | ||
| • кипения |
265,5 °C (760 мм. рт. ст) 144,2—144,8 °C (12 мм. рт. ст) °C |
||
| Классификация | |||
| Рег. номер CAS | 103-82-2 | ||
| PubChem | 999 | ||
| Рег. номер EINECS | 203-148-6 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30745 | ||
| ChemSpider | 10181341 | ||
| Безопасность | |||
| ЛД50 | 5000 мг/кг | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фенилу́ксусная кислота́ (α-толуи́ловая кислота́, химическая формула — C8H8O2 или С6H5СH2COOH) — cлабая химическая органическая кислота, относящаяся к классу карбоновых кислот ароматического ряда.
При стандартных условиях, фенилуксусная кислота — это блестящие иглы с запахом меда.
Соли фенилуксусной кислоты называются фенилацета́тами.
Физические и химические свойства[править | править код]
Соединение имеет вид блестящих игл с медовым запахом, в случае больших разведений запах изменяется, приобретая цветочный оттенок. Имеет молярную массу 136,15 г/моль, температуру плавления 77—78,5 °C, температуру кипения 265,5 °C (760 мм рт. ст), 144,2—144,8 (12 мм рт. ст), относительную плотность = 1,228, показатель преломления = 1,450—1,454, pKa в воде = 4,31(25 °C)[1].
Имеет хорошую растворимость в органических растворителях, в том числе в диэтиловом эфире и этиловом спирте. Плохо растворима в воде — 1,66 г/100 г воды (20 °C)[1].
Получение[править | править код]
Большинство синтезов фенилуксусной кислоты исходят из бензилгалогенидов. Фенилуксусная кислота может быть синтезирована гидролизом бензилнитрила, получаемого, в свою очередь взаимодействием бензилбромида с цианидом натрия: [2]
Другой метод синтеза — взаимодействие бензилхлорида с магнием и дальнейшее взаимодействие образовавшегося реактива Гриньяра с углекислотой[3]:
- PhCH2Cl + Mg PhCH2MgCl
- PhCH2MgCl + CO2 PhCH2COOMgCl
- PhCH2COOMgCl + H2O PhCH2COOH + Mg(OH)Cl
Фенилуксусная кислота также может быть синтезирована карбонилированием бензилового спирта в присутствии родиевых катализаторов[4]
Применение[править | править код]
Фенилуксусную кислоту и её эфиры применяют при составлении парфюмерных композиций и пищевых эссенций (как отдушку восков и меда). Фенилуксусная кислота служит исходным продуктом для синтеза амфетамина, обладающего сильным стимулирующим действием и, вследствие этого, входит в список прекурсоров, подлежащих контролю в РФ[5]. Добавление фенилуксусной кислоты в культуральные среды используется в микробиологическом синтезе бензилпенициллина плесенями Penicillium chrisogenum или Penicillium notatum.
Нахождение в природе[править | править код]
Содержится в растениях (в частности, табаке) и некоторых эфирных маслах. По некоторым данным, фенилуксусная кислота, синтезируемая растениями, может проявлять ауксинподобную активность[1][6][7].
У животных фенилуксусная кислота синтезируется из фенилаланина, затем разлагается и выводится из организма в виде фенилпировиноградной кислоты[1], у человека наличие фенилуксусной кислоты в моче и поте при фенилкетонурии, обуславливающее их специфический «мышиный» запах является одним из диагностических признаков.
Безопасность[править | править код]
Полулетальная доза ЛД50 фенилуксусной кислоты перорально для кроликов составляет 5 г/кг[1].
Примечания[править | править код]
- ↑ 1 2 3 4 5 Хейфиц, 1998.
- ↑ Adams, Roger; Thal, A. F. Phenylacetic acid (англ.) // Organic Syntheses[англ.] : journal. — 1963. — Vol. 1. — P. 436.
- ↑ Robert A. Benkeser, Alvin E. Trevillyan, Jean M. Mallan, The reaction of the methylbenzylmagnesium halides with carbon dioxide, Journal of Organometallic Chemistry, Volume 2, Issue 4, October 1964, Pages 322—328, ISSN 0022-328X (недоступная ссылка), DOI: 10.1016/S0022-328X(00)82218-4.
- ↑ Jiarong Duan, Jing Jiang, Junfang Gong, Qinghua Fan, Dazhi Jiang, Synthesis of phenylacetic acid by carbonylation, Journal of Molecular Catalysis A: Chemical, Volume 159, Issue 1, 22 September 2000, Pages 89-96, ISSN 1381—1169 (недоступная ссылка), DOI: 10.1016/S1381-1169(00)00175-8.
- ↑ Постановление Правительства РФ от 30.061998 № 681 «Об утверждении Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ» (в редакции 22.01.2010 г.)
- ↑ Wightman, Frank; Lighty, Douglas L. Identification of phenylacetic acid as a natural auxin in the shoots of higher plants (англ.) // Physiologia Plantarum[англ.] : journal. — 1982. — Vol. 55. — P. 17. — doi:10.1111/j.1399-3054.1982.tb00278.x.
- ↑ Victoria Leuba; Duane LeTourneau. Auxin activity of phenylacetic acid in tissue culture (англ.) // Journal of Plant Growth Regulation : journal. — Vol. 9. — P. 71—76. — doi:10.1007/BF02041944.
Литература[править | править код]
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров. — М.: МЦФЭР, 2000. — 147 с.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — 188 с.
- Хейфиц Л. А. Фенилуксусная кислота // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 68. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.