Перегруппировка Вольфа
Перегруппировка Вольфа (перегруппировка Вольфа-Шрётера) — реакция в органической химии, в которой α-диазокарбонильное соединение превращается в кетен потерей азота, сопровождающейся 1,2-перегруппировкой[1]. В перегруппировке Вольфа кетен является интермедиатом, который может далее подвергаться нуклеофильной атаке со слабокислыми нуклеофилами (такими как вода, спирты, амины), образуя производные карбоновых кислот или продукт [2+2]-циклоприсоединения, содержащий четырёхчленный цикл. Механизм перегруппировки Вольфа был предметом обсуждения с момента его первого использования, но ни один из предложенных механизмов не описывает реакцию полностью[2]. Реакция открыта Людвигом Вольфом в 1902 году[3]. Перегруппировка Вольфа имеет широкое применение в органическом синтезе благодаря доступности α-диазакарбонильных соединений, разнообразию реакций с участием кетенового интермедиата и стереохимическому удержанию мигрирующей группы[2]. Тем не менее, перегруппировка Вольфа имеет ограничения из-за высокой реакционной способности α-диазокарбонильных соединений, которые могут претерпевать различные конкурирующие реакции[1].
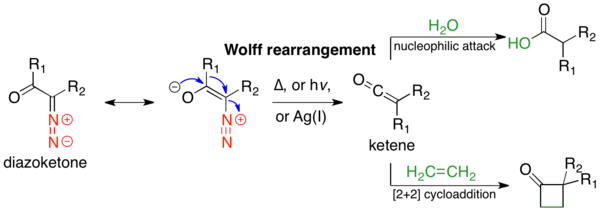
Перегруппировка Вольфа может быть инициирована термолизом[3], фотолизом[4] или катализом переходным металлом[3]. В последнем случае реакция чувствительна к выбору металла (обычно используется оксид серебра или соединения Ag(I)). Перегруппировка Вольфа имеет широкое применение в органическом синтезе, главным образом для получения производных карбоновых кислот. Реакция Арндта-Айстера частный случай перегруппировки Вольфа. Другое частное использование — уменьшение цикла. Если α-диазокарбонильное соединение имеет циклическое строение, то перегруппировка Вольфа приводит к сокращению цикла. Реакция хорошо идёт при создании циклических деформированных систем, когда другие реакции не подходят.
История[править | править код]
В 1902 году Людвиг Вольф обнаружил, что при обработке диазоацетофенона водой в присутствии оксида серебра образуется фенилуксусная кислота, а при обработке аммиаком вместо воды образуется фенилацетамид[3]. Через несколько лет эту реакцию независимо наблюдал Шрётер[5]. Поэтому реакция иногда называется перегруппировкой Вольфа-Шрётера[2]. Первоначально реакция не имела широкого применения до тех пор, пока в 1930-х не был обнаружен лёгкий способ синтезирования диазакетонов[1][2].

Механизм[править | править код]
Механизм перегруппировки Вольфа был предметом обсуждения с момента его первого использования, но ни один из предложенных механизмов не описывает реакцию полностью. Тем не менее, две стадии механизма могут быть согласованы. Во-первых, α-диазокарбонильные соединения находятся в равновесии S-(Z) и S-(Е) конформеров, распределение которых может влиять на механизм реакции. Как правило, при фотолизе соединения в S-(Z) конформации реагируют ступенчато за счет торсионного угла в 150°-180° между покидающей и мигрирующей группами, в то время как соединения, в S-(Е) конформации реагируют через промежуточный карбен или не реагируют. Во-вторых, независимо от механизма реакции, перегруппировка дает промежуточный кетен, который может быть захвачен слабокислым нуклеофилом, таким как спирт или амин, с получением соответствующего сложного эфира или амида, или олефином с получением [2+2]-циклоприсоединения аддукта. Сильные кислоты не дают перегруппировки Вольфа, а протонируют α-углерод и дают продукты реакции по механизму SN2.

Стереохимия α-диазокетонов[править | править код]
Понимание стереохимии α-диазокетонов имеет важное значение для понимания механизма перегруппировки Вольфа. α-диазокарбонильные соединения, как правило, локально плоские, с большими вращательными барьерами (55-65 кДж / моль) из-за C=C связи между карбонильной группой и α-углеродом, что показанном в крайней правой резонансной структуре[6]. Такой большой барьер замедляет молекулярные повороты достаточно, чтобы привести к равновесию между двумя S-(Z) и S-(E) конформерами. Как видно в крайней правой резонаторной структуре, в S-(Z) конформации между кислородом с частичным отрицательным зарядом и диазагруппой с частичным положительным зарядом возникает дополнительное Кулоновское взаимодействие[1]. В этом случае, если R1 является большим радикалом, а R2 водородом, то S-(Z) конформер предпочтителен. Если R1 и R2 достаточно большие, предпочтителен S-(Е) конформер, так как сила их отталкивания больше силы Кулоновского взаимодействия. Малые и средние циклические субстраты ограничены в S-(Z) конформации.

Согласованный механизм[править | править код]
Когда α-диазокетон находится в S-(Z) конформации, уходящая группа (N2) и мигрирующая (R1) находятся под углом в 150°-180°, что приводит к реакции по согласованному механизму, в котором одновременно с отщеплением азота происходит 1,2-алкильный сдвиг. Существует доказательство того, что этот механизм имеет место при термолизе и фотолизе, когда сильно преобладает S-(Z) конформер[7].

Исследования химической поляризации ядер показывают, что фотохимическая перегруппировка диазоацетона, существующий преимущественно в S-(Z) конформере происходит по согласованному механизму[8]. Соотношения продуктов от прямого и триплет-чувствительного фотолиза были использованы для доказательства того, что перегруппировка S-(Z) конформеров идёт по согласованному механизму, а S-(E) конформеров по ступенчатому[9].
См. также[править | править код]
Ссылки[править | править код]
- ↑ 1 2 3 4 Kirmse, W. 100 Years of the Wolff Rearrangement (англ.) // Eur. J. Org. Chem.[англ.] : journal. — 2002. — Vol. 2002, no. 14. — P. 2193. — doi:10.1002/1099-0690(200207)2002:14<2193::AID-EJOC2193>3.0.CO;2-D.
- ↑ 1 2 3 4 Gill, G. B. (1991) «The Wolff Rearrangement.» in Trost, B. M. Flemming, I. (eds.) Comp. Org. Synth. Oxford: Pergamon. 3:887. doi:10.1016/B978-0-08-052349-1.00085-8. ISBN 978-0-08-052349-1
- ↑ 1 2 3 4 Wolff, L. Ueber Diazoanhydride (нем.) // Justus Liebigs Ann. Chem.[англ.] : magazin. — 1902. — Bd. 325, Nr. 2. — S. 129. — doi:10.1002/jlac.19023250202.
- ↑ Horner, L. Spietschka, E. Gross, A. W. Zur Kenntnis der Umlagerungsvorgänge bei Diazo-ketonen, o-Chinondiaziden und Säureaziden (нем.) // Justus Liebigs Ann. Chem.[англ.] : magazin. — 1951. — Bd. 573. — S. 17. — doi:10.1002/jlac.19515730103.
- ↑ Schroeter, G. Über die Hofmann-Curtiussche, die Beckmannsche und die Benzilsäure-Umlagerung (нем.) // Chem. Ber.[англ.] : magazin. — 1909. — Bd. 42, Nr. 2. — S. 2336. — doi:10.1002/cber.190904202131.
- ↑ Pecile, C. Foffani, F. Chersetti, S. The interaction of diazocarbonyl compounds with hydroxylic solvents (англ.) // Tetrahedron : journal. — 1964. — Vol. 20, no. 4. — P. 823. — doi:10.1016/S0040-4020(01)98414-5.
- ↑ Kaplan, F. Meloy, G. K. The Structure of Diazoketones. A Study of Hindered Internal Rotation1,2 (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 1966. — Vol. 88, no. 5. — P. 950. — doi:10.1021/ja00957a017.
- ↑ Roth, H. D. Manion, M.L. Solution photochemistry of diazoacetone. Wolff rearrangement and acetylmethylene (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 1976. — Vol. 98, no. 11. — P. 3392. — doi:10.1021/ja00427a067.
- ↑ Tomioka, H. Okuno, H. Kondo, S. Izawa, Y. Direct evidence for ketocarbene-ketocarbene interconversion (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 1980. — Vol. 102, no. 23. — P. 7123. — doi:10.1021/ja00543a050.